Применение опорных схем при преподавании темы «Кислоты, основания, соли в свете ТЭД»
Комплект опорных схем [9] (рис. 2), применяемых при изучении темы «Электролитическая диссоциация», состоит из четырех обобщающих схем (ОС):
ОС-1. Электролитическая диссоциация.
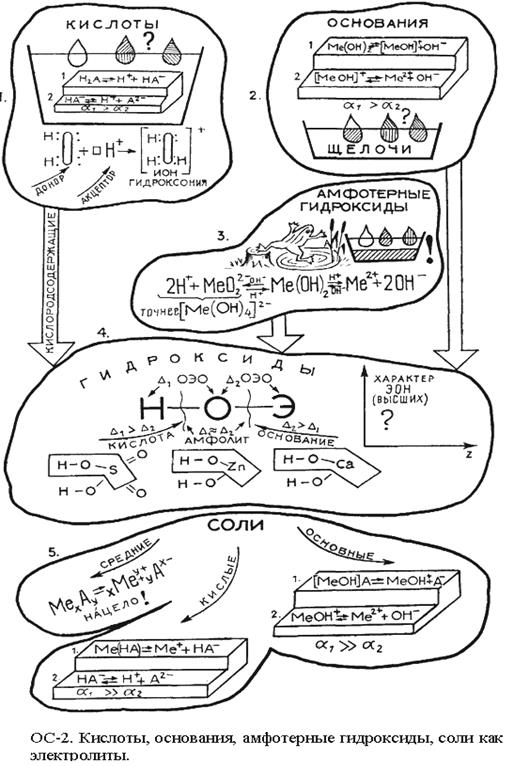
ОС-2. Кислоты, основания, амфотерные гидроксиды, соли как электролиты.
ОС-3. Реакции ионного обмена.
OC-4. Гидролиз солей.
Приведем краткий сопроводительный текст к обобщающей схеме «ОС-2.
Кислоты, основания, амфотерные гидроксиды, соли как электролиты». Он может быть использован при повторном объяснении материала или при воспроизведении его учащимися.
ОС-2.
Кислоты, основания, амфотерные гидроксиды, соли как электролиты (рис. 2).
1. Кислоты
Кислоты – это электролиты, при диссоциации которых в водных растворах образуются только катионы водорода (протоны). Наличием катионов водорода в растворах кислот и объясняются их общие свойства, в частности изменение окраски индикаторов.
Многоосновные кислоты диссоциируют ступенчато, причем по первой ступени степень диссоциации всегда больше, чем на последующим.
Процесс диссоциации кислот в водных растворах сопровождается донорно-акцепторным взаимодействием положительно поляризованных атомов водорода с молекулами воды, в результате чего образуются гидратированные ионы водорода (ионы гидроксония).
2. Основания
Основания – электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы ОН- . Двухкислотные основания диссоциируют ступенчато. При этом, как и в случае многоосновных кислот, a1 > a2. Растворимые основания (щелочи) изменяют окраску индикаторов.
3. Амфотерные гидроксиды
Термины «амфотерность», «амфолит» отражают кислотно-основную двойственность вещества («amphi» – «и тот, и другой»). Этот же корень содержится в слове «амфибия», о чем напоминает изображение лягушки. Амфотерные гидроксиды плохо растворимы в воде и не изменяют окраски индикаторов. Это слабые электролиты. Их двойственность проявляется в способности диссоциировать как по основному, так и по кислотному типу. В кислой среде усиливается диссоциация по основному типу, в щелочной – по кислотному с образованием гидроксокомплексных анионов, например [Аl(ОН)6]3-, [Zn(OH)4]2-.
4. Гидроксиды
Сравнение графических формул кислородсодержащих кислот (например, H2SO4), амфотерных гидроксидов (Zn(OH)2) и оснований (Са (ОН)2) позволяет установить сходство в их строении: наличие одинаковой последовательности соединения атомов Н-О-Э. Это позволяет объединить указанные группы веществ общим понятием - гидроксиды. Способность гидроксидов к диссоциации по кислотному, основному или амфотерному типу зависит от сравнительной полярности связей Н- О и О-Э. Если связь Н-О более полярна, чем О-Э, разность между относительной электроотрицательностью кислорода и водорода (D1 ОЭО) больше разности ОЭО кислорода и элемента (D2 ОЭО), то гидроксид диссоциирует в водном растворе как кислота (отщепляя H+-ионы). Если связь О-Э более полярна, чем О-Н (D2 ОЭО > D1 ОЭО), то гидроксид диссоциирует по основному типу. И, наконец, если связи Н-О и О-Э примерно равнополярны (D1 ОЭО » D2 ОЭО), гидроксид проявляет амфотерные свойства (амфолит).
5. Соли. В зависимости от состава соли подразделяются на средние, кислые и основные. Все соли – сильные электролиты. Средние соли диссоциируют нацело на катионы металлов и анионы кислотных остатков. Кислые и основные соли диссоциируют ступенчато: по первой ступени – как сильные электролиты (кислые соли - на катионы металлов и гидроанионы, основные – на гидроксо - катионы и анионы кислотных остатков); вторая ступень – диссоциация гидроанионов или гидроксокатионов (в случае основных). Эти частицы обычно слабые электролиты (a1 >> a2).
Такая форма подачи материала, на мой взгляд, наиболее удобна и интересна. При рассмотрении этой темы просматривается достаточно сильно постоянная связь с такими дисциплинами, как, в первую очередь, физика, а также математика. Вообще рассмотрение таких понятий, как «электропроводность», «электролит» и «неэлектролит», «полярность связи», «степень диссоциации» невозможно без ссылки на ранее приобретенные учащимися знания по физике [10-15,16,18].
В эксперименте принимали участие ученики 9 классов СОШ № 9 г. Нальчика, 9 «а» (экспериментальный), 9»б» и 9 «в» (контрольный) классы. Выборочная совокупность составляла 61 человек.
В экспериментальном классе при раскрытии темы «Основания» были проведены уроки, приведенные в главе 3. Уроки проводились с акцентом на научные и экологические аспекты, которые закреплялись в процессе формулирования, анализа и последующего решения целей и задач урока.
Тест и его классификации
Тест - краткое экспериментально-психологическое испытание для определения высоты развития какой-либо функции. [23,с.395]. Среди тестов, которые используются для выяснения успеваемости учащихся выделяют различные классификации тестов: По цели применения существуют констатирующие (констатируют знания ...
Динамика развития нравственных представлений у детей с нарушениями слуха
старшего дошкольного возраста
Цель экспериментальной работы – выявление динамики развития нравственных представлений у слабослышащих детей старшего дошкольного возраста. Для достижения цели нами были использованы те же методики, что и на констатирующем этапе. В ходе исследования получили следующие результаты. Уровни развития нр ...
Использование компьютерных моделей при обучении физике
Сегодня преподаватели и учителя физики, сталкиваются со следующим рядом затруднений: постоянное сокращение часов на естественнонаучные дисциплины, снижение финансирования учебного процесса, износ и выход из строя имеющегося оборудования. В сочетании с повышенными требованиями к уровню знаний выпуск ...
Задачи, стоящие перед высшей школой, требуют ее всестороннего совершенствования.
Инновационные процессы, идущие сегодня в системе образования наиболее остро ...
Разделы
- Главная
- Педагогическая деятельность
- Нравственное воспитание младших школьников
- Система образования в Австралии
- Современные концепции воспитания
- Воспитательная система сельской школы
- Обучение детей дошкольного возраста
- Комплексная педагогика

